Các bí quyết hóa học 12 cơ phiên bản giúp học viên giải nhanh bài tập trắc nghiệm trong thời hạn ngắn. Lưu giữ được hết những công thức này, teen 2K1 sẽ chẳng yêu cầu "e dè" đề dài, đề nặng nề nữa.
Bạn đang xem: Các công thức giải nhanh trắc nghiệm hóa học
TRỌN BỘ ĐỀ + LỜI GIẢI bỏ ra TIẾT 9 MÔN ĐỀ MINH HỌA 2020 LẦN 2
Nhận sách CC Thần tốc luyện đề ôn thi Đại học không lấy phí TẠI ĐÂY
Gợi ý lựa chọn tài liệu ôn thi THPT đất nước 2020 full 8 môn
Đồng giá chỉ 99k/ cuốn CC Thần tốc luyện đề 2020 - cỗ 45 đề thi chuẩn kết cấu Bộ giáo dục có đáp án bỏ ra tiết
Đồng giá chỉ 168k/ cuốn bí quyết chinh phục điểm cao kì thi THPT tổ quốc -> cuốn sách NÂNG CAO ôn TỰ LUẬN thi Bách Khoa, nước ngoài thương
Đột phá 8+ kì thi thpt Quốc gia: Trọn bộ kiến thức + dạng bài xích mẫu xuyên thấu 3 năm THPT
Ôn luyện kì thi trung học phổ thông Quốc gia
Infographic kì thi thpt Quốc gia
Xem lại văn bản cắt giảm KHÔNG THI thpt QG 2020 tại đây
1090 câu hỏi trắc nghiệm địa lý 12 bao gồm đáp án
Các phương pháp hóa học giúp giải nhanh bài tập trắc nghiệm thi thpt Quốc gia
Công thức chất hóa học cơ phiên bản 12 phần vô cơ
Bài viết bên dưới đây, CCBook sẽ share với những em tổng cộng 25 công thức hóa học tập 12 cơ bản. Các công thức này hoàn toàn có thể giúp teen 2K1 tuyển chọn được đáp án đúng đắn trong thời gian ngắn.
Trước hết bọn họ cần điểm qua kỹ năng Hóa học tập vô cơ trong công tác lớp 12. Ở năm học tập cuối cấp các em cần chăm chú những siêng đề phần Vô cơ đặc trưng như:
- Đại cưng cửng về kim loại.
- kim loại kiềm, kiềm thổ, nhôm
- fe và một số kim nhiều loại quan trọng.
Mỗi chăm đề sẽ có không ít dạng câu hỏi khác nhau. Để các em gọi sâu được phương pháp tính cấp tốc cho từng dạng bài, CCBook đã tổng hợp cách làm tính cấp tốc cho từng siêng đề.
Công thức hóa học 12 cơ bạn dạng về đại cưng cửng kim loại

Kim các loại + axit (H2SO4 loãng tốt HCl)→ muối bột sunfat + H2↑
1. Mmuối sufat = mkim một số loại + 96 n
H2
2. Mmuối clorua = mkim loại + 71 n
H2
Ví dụ: cho 5.2g hỗn hợp Al, Fe, với Mg vào dd HCl dư thu được 22,4l H2 (đktc). Cô cạn dung dịch được bao nhiêu gam muối hạt khan?
Ta có n
H2 = 0,1 mol
3. M muối bột = m kim loại + 71.0.1 = 5,2 + 7,1 = 12,3 g
Dạng 2:Muối cacbonat + axit (H2SO4 loãng tuyệt HCl)→ muối hạt (sunfat hoặc muối hạt clorua) + CO2
4. Mmuối sufat = m muối cacbonat + 36n
CO2 vì chưng CO32- + H2SO4 →SO42- + CO2 + H2O
5. Mmuối cloru = m muối bột cacbonat + 11 n
CO2 vì chưng CO32- + HCl → 2Cl- + CO2 + H2O
Muối cacbonat + axit (H2SO4 loãng xuất xắc HCl) → muối bột (sunfat hoặc muối bột clorua) + CO2
6. Mmuối sunfat = m muối hạt cacbonat + 36n
CO2 do CO32- + H2SO4 SO42- + CO2 + H2O
7. Mmuối clorua= m muối hạt cacbonat + 11 n
CO2 vày CO32- + HCl 2Cl- + CO2 + H2O
8. Mmuối sunfat = m
KL + 96/2. (2n
SO2 + 6n
S + 8n
H2S ) = m
KL + 96. (n
SO2 + 3n
S + 4n
H2S).
Lưu ý về sản phẩm khử, sản phầm nào không tồn tại thì tự quăng quật qua.
9. N
H2SO4 = 2n
SO2 + 4n
S + 5H2S
Khi cho kim loại tính năng với dd axit HNO3 giải phóng các khí: NO2, NO, N2O, N2, NH4NO3. Bí quyết tính muối nitrat.
10. Mmuối nitrat = m
KL + 62. ( n NO2 + 3n
NO + 8N2O + 10n
N2 + 8n NH4NO3).
Khi mang lại muối cacbonat tác dụng với dd H2SO4 loãng mang đến khí CO2 và H2O, phương pháp tính khối lượng muối sunfat.
11. M muối bột sunfat = m muối hạt cacbonat + 36n
CO2
Công thức chất hóa học 12 cơ bản để tính lượng muối bột clorua khi cho muối sunfat tác dụng với dd HCl cho khó SO2 và H2O.
12. M muối bột clorua = m muối sunfat – 9.n
SO2
Tính trọng lượng muối sunfat khi đến muối sunfit công dụng với dd H2SO4 loãng tạo nên khí CO2 và H2O.
Dạng 8:Công thức tính lượng HNO3 cần dùng để hoàn tan hỗn hợp kim loại:
13. M
HNO3 = 4n
NO + 2n
NO2 + 10n
N2O + 12n
N2 + 10NH4NO3
Lưu ý: lúc phản ứng không giải phóng khí làm sao thì số mol khí kia = 0 .
Kim một số loại trong tất cả hổn hợp không làm ảnh hưởng đến quý giá của HNO3.
Khi HNO3 công dụng Fe3+ yêu cầu phải để ý Fe có thể khử Fe3+ về Fe2+. Hôm nay số mol HNO3 đã dùng làm hòa tan tất cả hổn hợp sẽ nhỏ hơn với hiệu quả tính theo công thức trên. Bởi vì thế, các em cần để ý đến đề bài bác nói HNO3 dư bao nhiêu %.
Dạng 9:Số mol H2SO4 sệt nóng yêu cầu để hoàn tan hỗn hợp kim loại phụ thuộc vào sản phẩm SO2 duy nhất.
14. N
H2SO4 = 2n
SO2
Khi mang đến hỗn kim loại tổng hợp loại công dụng với HNO3 (Phản ứng không tạo NH4NO3).
15. Mmuối= mkl+ 62( 3n
NO+ n
NO2+ 8n
N2O+10n
N2)
Chú ý: Khi mang đến Fe3+ tác dụng với HNO3 thì HNO3 phải dư.
Ngoài những công thức chất hóa học cơ bản lớp 12, teen 2K1 cũng hãy ôn lại:
Tổng hợp kỹ năng Hóa học tập lớp 10 thường mở ra trong các bài thi
Công thức hóa học 12 cơ phiên bản để giải nhanh các dạng bài xích tập liên quan đến fe và một vài kim các loại quan trọng

Bài toán về fe và một vài kim một số loại quan trọng
16. Tính trọng lượng của muối bột thu được sau phản bội ứng của hỗn hợp sắt, oxit fe với HNO3 dư cùng giải phóng lúc NO:
m
Muối=(mhỗn hợp+ 24n
NO)
17. Khối lượng muối chiếm được khi trả tan hỗn hợpFe,Fe
O, Fe2O3,Fe3O4 với HNO3 đặc, nóng, dư giải tỏa NO2.
m
Muối=mhỗn hợp+ 8n
NO
18. Nếu như phản ứng giải phóng cả NO cùng NO2 thì công thức tính như sau.
m
Muối= (mhh+ 8.n
NO2+24.n
NO)
19. Phương pháp để tính lượng muối thu được khi phối hợp hết hh
Fe,Fe
O, Fe2O3,Fe3O4với H2SO4 đặc, nóng, dư chế tác khí SO2.
m
Muối= (mh2+ 16n
SO2)
20. Lúc oxi hóa lượng sắt bởi oxi sản xuất hỗn hợn chất rắn X. Phối hợp X cùng với dd HNO3 loãng, dư được NO. Cân nặng sắt ban đầu tham gia bội nghịch ứng:
m
Fe= (mh2+ 24n
NO)
21. Bài toán giống như nhie trên nhưng mà khí giải tỏa sau phản bội ứng là NO2:
m
Fe= (mh2+ 8n
NO2)
Bài toán về dd kiềm, kiềm thổ cùng nhôm- phương pháp hóa học tập 12 cơ bản
22. Công thức hóa học tập 12 cơ bạn dạng tính thể tích NO (NO2) khi thành phầm sau làm phản ứng nhiệt nhôm công dụng với HNO3.
n
NO= (3.n
Al+ (3x -2y)n
Fex
Oy
n
NO2= 3n
Al+ (3x -2y)n
Fex
Oy
23. Dung dịch
Mn+ tác dụng với dd kiềm, xác định kim nhiều loại M cóhiđroxit lưỡng tính.
Số mol OH- đề nghị dùng để
Mn+ kết tủa không còn và tiếp đến tan vừa hết:
n
OH-= 4n
Mn+= 4n
M
24. Bài toán khẳng định kim nhiều loại M phụ thuộc vào phản ứng của dd Mn+với dd MO2n-4hay
Số mol H+ dùng để làm kết tủa
M(OH)n cực lớn sau đó tan hết:
n
H+= 4n
MO2n-4= 4n
25. Cân nặng củaFe2O3 sau thời điểm cho teo đi qua, nung nóng. Hòa tan sản phẩm rắn vào H2SO4 đặc nóng, dư giải tỏa khí SO2.
m =( mx+ 16n
SO2)
Trên đấy là tổng cộng 25 công thức hóa học lớp 12 cơ bạn dạng giúp học sinh giải cấp tốc được thắc mắc trắc nghiệm. Các em yêu cầu ghi lưu giữ số công thức trên bằng phương pháp làm bài xích tập thật nhiều. Làm bài bác tập để hiểu sâu nguyên nhân tại sao lại áp dụng công thức đó.Đừng áp dụng một bí quyết máy móc. Vì chưng đề thi ngày càng tất cả các câu hỏi mới lạ và phân nhiều loại cao. Rất cần được có sự áp dụng linh hoạt các công thức.
Ôn tập tất tần tật bí quyết hóa học tập 12 cơ bản, cách làm 10, 11 trọng tâm

Sách tổng hợp những công thức chất hóa học 12 cơ bản giải nhanh tất tần tật bài tập
Bên cạnh việc học các công thức giải nhanh bài bác tập hóa học phần vô cơ trên, các em cũng cần ghi nhớ phương pháp tính cấp tốc phần hữu cơ. Đề thi sẽ kiểm tra kỹ năng trong 3 năm của các em nên không được học tủ, học tập lệch.
Để học thật đều kiến thức và kỹ năng Hóa học tập của 3 năm, teen 2K1 hãy xem thêm cuốn sách Đột phá 8+ kì thi THPT tổ quốc môn Hóa học. Cuốn sách có khối hệ thống cả bài tập và lý thuyết đặc biệt của năm 10,11 cùng 12.
Song tuy nhiên với lý thuyết đều có ví dụ minh họa để những em đọc được thực chất của vụ việc nhanh chóng. Bài bác tập được phân dạng có phương thức giải theo tức thì sau. Học viên sẽ đọc được lý do sử dụng cách làm tính nhanh, vận dụng chúng linh hoạt để giải gần như dạng bài xích tập.
Trong số sách luyện thi THTP quốc gia môn Hóa thì đây là cuốn đầu tiên trên thị trường tổng hợp kiến thức 3 năm học. Những em sẽ chưa hẳn học rất nhiều sách luyện thi trung học phổ thông Quốc gia. Chỉ cần chịu khó ôn luyện kiến thức trong SGK và bổ sung cập nhật với Đột phá 8+ là những em rất có thể dành được số điểm đáng mơ ước.
Đối với mèo Tom, chất hóa học đã tàn phá đời anh ấy nhiều hơn Toán, Lý! tuy nhiên với công thức sử dụng cho trắc nghiệm, các bạn sẽ không gặp rắc rối như Tom. Các bạn chẳng đề nghị quan tâm, mày mò chi cho mệt. Đơn giản các bạn chỉ ghi vài dòng, bấm máy thiết yếu xác, sơn A, B, C, D cho đẹp. Tuy nhiện, phải cảnh giác đấy, lợi trước mắt, sợ lâu dài!
Công thức tính nhanh hóa học tập để giải quyết và xử lý nhanh-gọn-lẹ toán hóa; mới chỉ xuất hiện từ cố gắng kỉ trăng tròn và đặc trưng 21!; khi chuyển từ thi Hóa trường đoản cú luận thành Hóa trắc nghiệm. Tiếng đây, rất nhiều bài toán tinh vi (giải cho vã mồ hôi) bạn có thể chẳng biết, chẳng quan tiền tâm, cũng chẳng thèm hiểu các chất đã chạm mặt gỡ rồi đưa hóa ra sao, hoặc hệ số cân đối thế làm sao (mặc dù đó là điều chính yếu và quan trọng đặc biệt của môn Hóa);bạn dễ dàng chỉ ghi vài ba dòng, cụ số chủ yếu xác, bấm máy mang lại đúng, cùng tô lời giải cho đẹp! …
Nhưng cảnh giác đấy; sau này, nếu bạn trở thành công ty hóa học; hoặc dược sĩ, các bạn sẽ không thể đánh trắc nghiệmA – Bò – Cá –Dê để hiểu và làm cho hóa (chưa kể tấn công lụi!); mà lại bạn cần phải biết phản ứng xẩy ra thế nào; có gian nguy hay bọn chúng kiêng kị cho nhau không?
Bất chấp tương lai bao gồm làm hóa giỏi không; vượt qua kì thi và lấy điểm trên cao là cái ai đang quan tâm. Mong vậy, bạn phải thuộc cách làm và biết dạng toán để vận dụng công thức đó; điều rất xích míc với bộ môn công nghệ tự nhiên. Tuy vậy …. Sẽ trở thành model được thanh niên săn lùng!
Nội dung bài bác viết
1. Cách làm tính muối hạt khi mang đến …1.1. Bội phản ứng với axit HCl, H2SO4 loãng1.2. Bội nghịch ứng với axit H2SO4 đặc, HNO32. Công thức toán CO2bơi lội trong dung dịch kiềm2.1. Lập tỉ lệ loại truyền thống2.2. Tính CO2 Ca
CO3, Ba
CO3">2.2.1. ? mol CO2 + Ca(OH)2 | Ba(OH)2 → tủa Ca
CO3 | Ba
CO3 với mol Ca2+, Ba2+ > Ca
CO3, Ba
CO32.2.2. Ngắm trang bị thị huyền thoại → search số cùng tính toán2.3. Tính tủa lúc CO2 + nhiều kiềm
Cho CO2 + Na
OH, Ba(OH)2, Ca(OH)2 → ? mol Ca
CO3, Ba
CO33. Công thức câu hỏi NHÔM3.1. Tính kết tủa Al(OH)33.2. Tính OH–3.3. Tính H+3.4. Câu truyện của Kẽm4. Công thức vấn đề SẮT4.1. Đốt sắt với O2 rồi bội nghịch ứng tiếp với HNO3Hỗn hợp Fe, Fe3O4, Fe2O3, … + HNO3 hoặc H2SO4 đặc → muối bột Fe(NO3)3 + NO, NO2 hoặc muối Fe2(SO4)3 + SO24.2. Oxit sắt cùng H2SO4 đặc
1. Cách làm tính muối khi cho …
1.1. Làm phản ứng với axit HCl, H2SO4 loãng
Kim một số loại R + HCl → ? muối clorua RCln + H2mmuối clorua= mkim nhiều loại phản ứng+ 71.nH2Kim loại R + H2SO4 loãng → ? muối sunfat R2(SO4)n + H2mmuối sunfat= mkim nhiều loại phản ứng+ 96.n
H2Oxit Rx
Oy + HCl | H2SO4 loãng → ? muối clorua | muối sunfat + H2Ommuối clorua= moxit+ 27,5.n
HCl= moxit+ 55.n
H2Omuối sunfat= moxit+ 80.n
H2SO4Muối cacbonat R2(CO3)n + HCl | H2SO4 loãng → ? muối clorua RCln | muối sunfat R2(SO4)n+ CO2 + H2Ommuối clorua= mmuối cacbonat+ 11.n
CO2mmuối sunfat= mmuối cacbonat+ 36.n
CO2Muối sunfit R2(SO3)n + HCl | H2SO4 → ? muối clorua | muối sunfat + SO2 + H2Ommuối clorua= mmuối sunfit – 9.n
SO2muối sunfat= mmuối sunfit + 16.n
SO2
1.2. Bội nghịch ứng với axit H2SO4 đặc, HNO3
Kim nhiều loại R + H2SO4 đặc → ? muối sunfat R2(SO4)n + SO2 (hoặc S, H2S) + H2Ommuối sunfat= mkim loại+ 48(2.nSO2+ 6.n
S+ 8.n
H2S)Tổng n
H2SO4= 2.n
SO2+ 4.n
S+ 5.n
H2SSản phẩm khử nào không có thì bỏ quaKim một số loại R + HNO3 → ? muối nitrat R(NO3)n ; NH4NO3-nếu có + NO2 (hoặc NO, N2O, N2, NH4+) + H2OTổng muối hạt nitrat =mmuối nitrat của kim loại R+m
NH4NO3=mkim loại+62(n
NO2+ 3.n
NO+ 8.n
N2O+ 10.n
N2+ 8.n
NH4+ <*>)+m
NH4NO3Tổng n
HNO3= 2n
NO2+ 4.n
NO+ 10.n
N2O+ 12.n
N2+ 10.n
NH4+*Sản phẩm khử nào không tồn tại thì vứt quaKim các loại R +
O
2. Công thức toán CO2bơi lội trong hỗn hợp kiềm
2.1. Lập tỉ lệ thứ hạng truyền thống
Khi còn béKhi học hóa lớp 10, 11; mình bao gồm cách giải bằng phương pháp lập tỉ lệ thành phần mol như sau:

Trong
Toan on cya.edu.vn

Trong
Toan on cya.edu.vn
Khi lớn hơn
Ở lớp 12, mình chỉ cần nhìn vào bí quyết hai muối hạt là biết ngay lập tức lập tỉ lệ mol nạm nào.
Bài toán CO2 + Na
OH → NaHCO3, Na2CO3 mình chỉ việc lập tỉ lệ thuận tiện là
Bài toán CO2 + Ba(OH)2 → Ba
CO3, Ba(HCO3)2 mình chỉ việc lập tỉ lệ thuận lợi là
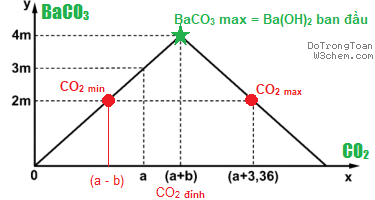
2.2. Tính CO2
2.2.1. ? mol CO2 + Ca(OH)2 | Ba(OH)2 → tủa CaCO3 | Ba
CO3 với mol Ca2+, Ba2+ > Ca
CO3, Ba
CO3
Ta bao gồm hai kết quả
nCO2 min = n
Ba
CO3n
CO2 max = n
OH- bđ – n
Ba
CO3 = 2n
Ba(OH)2 bđ – n
Ba
CO3 CO2 đỉnh chế tạo n
Ba
CO3 max = n
Ba(OH)2 bđ
Hấp thụ không còn V lít CO2 (đo làm việc đktc) vào dung dịch tất cả 0,3 mol Ba(OH)2
thu được 0,1 mol kết tủa. Tính V?
0,3 mol Ba(OH)2⇒ n
OH-= 0,3.2 = 0,6
Đề không hỏi min giỏi max yêu cầu ta gồm 2 công dụng như sau:
nCO2 min= ntủa= 0,1 ⇒ VCO2 min= 2,24 litn
CO2 max= n
OH-– ntủa= 0,6 – 0,1 = 0,5 ⇒ VCO2 max= 11,2 lit
2.2.2. Ngắm thứ thị lịch sử một thời → tìm số và tính toán
***Cảnh báo: ví như quá vớ vẩn với bạn, xin hãy bỏ lỡ nội dung này.
Sở dĩ tất cả hai trị CO2 do
khi CO2 min ứng với chỉ xảy ra 1 phản nghịch ứng1CO2 + 1Ba(OH)2 dư → Ba
CO3 + H2O
<1> CO2 bội nghịch ứng nhàn nhã với Ba(OH)2 tạo ra tủa Ba
CO3 cho đến max
1CO2 + 1Ba(OH)2 không còn → Ba
CO3 max + H2O
<2> CO2 liên tiếp hòa tan một phần Ba
CO3
1CO2 + 1Ba
CO3 một trong những phần + H2O → Ba(HCO3)2 tan
Dẫn từ bỏ từ mang lại dư khí CO2 vào dung dịch Ba(OH)2. Sự dựa vào của
khối lượng kết tủa (y gam) vào thể tích khí CO2 gia nhập phản ứng (x lít) được màn biểu diễn bằng đồ thị bên dưới. Quý hiếm của m là A. 19,70. | B. 39,40. | C. 9,85. | D. 29,55. (Đề xem thêm 2019)
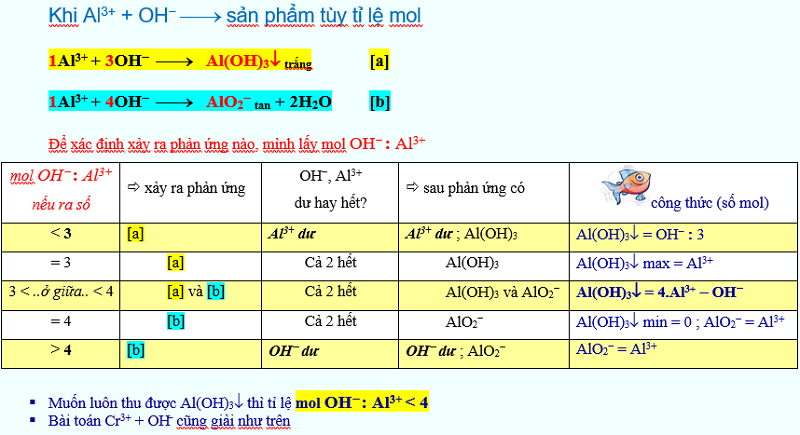
Ví dụ 1.Cho 0,3 mol Na
OH vào dung dịch gồm 0,2 mol Al3+. Tính số mol kết tủa thu được?
Al(OH)3= OH−:3 = 0,3 : 3 = 0,1 mol
Ví dụ 2.Cho 0,6 mol Na
OH vào dung dịch gồm 0,2 mol Al3+. Tính số mol kết tủa thu được?
Al(OH)3= Al3+= 0,2 mol
Ví dụ 3.Cho 0,7 mol Na
OH vào dung dịch tất cả 0,2 mol Al3+. Tính số mol kết tủa thu được?
Al(OH)3= 4.Al3+– OH–= 4.0,2 – 0,7 = 0,1 mol
Ví dụ 4.Cho 0,9 mol Na
OH vào dung dịch bao gồm 0,2 mol Al3+. Tính số mol kết tủa thu được?
Al(OH)3= 0
3.2. Tính OH–
Tính NaOH + Al3+ → tủa Al(OH)3 với mol Al3+ > Al(OH)3
Ta tất cả hai kết quả
mol OH–min= 3.ntủamol OH–max= 4.nAl3+– ntủa
Nếu dung dịch gồm thêm H+; mìnhcộng thêm mol H+vào hai công thức trên, khi đómol OH–min= 3.ntủa+ n
H+mol OH–max= 4.n
Al3+– ntủa+ n
H+
Ví dụ 1.Cho V lít dung dịch Na
OH 1M vào dung dịch đựng 0,5 mol Al
Cl3; nhận được 0,4 mol Al(OH)3. Tính V?
Vì đề không hỏi min giỏi max cần mình có
mol OH–min= 3.ntủa⇒ 1.Vmin= 3.0,4 ⇒ Vmin= 1,2 litmol OH–max= 4.nAl3+– ntủa⇒ 1.Vmax = 4.0,5 – 0,4 ⇒ Vmax= 1,6 lit
Ví dụ 2.Cho V lít hỗn hợp Na
OH 1M vào dung dịch chứa đồng thời 0,6 mol Al
Cl3và 0,2 mol HCl; sau phản nghịch ứng nhận được 0,5 mol Al(OH)3. Tính V?
Bài này cho thêm H+, tương tự như mình có
mol OH–min= 3.ntủa+ nH+⇒ 1.Vmin= 3.0,5 + 0,2 ⇔ Vmin= 1,7 litmol OH–max= 4.n
Al3+– ntủa+ n
H+⇒ 1.Vmax = 4.0,6 – 0,5 + 0,2 ⇔ Vmax= 2,1 lit
3.3. Tính H+
Tính mol H+ + AlO2– → tủa Al(OH)3 với mol Al
O2–> Al(OH)3
Ta gồm hai kết quả
mol H+min= ntủamol H+max= 4.nAl
O2-– 3.ntủa
Nếu dung dịch gồm thêm OH–; mìnhcộng thêm mol OH–vào hai phương pháp trênmol H+min= ntủa+ n
OH-mol H+max= 4.n
Al
O2-– 3.ntủa+ n
OH-
Ví dụ 1.Tính V hỗn hợp HCl 1M nên thêm vào dung dịch cất 0,7 mol Na
Al
O2để chiếm được 0,5 mol Al(OH)3?
Al
O2-– 3.ntủa⇒ 1.Vmax= 4.0,7 – 3.0,5 ⇔ Vmax= 1,3 lit
Ví dụ 2.Tính V hỗn hợp HCl 1M lớn số 1 cần bỏ vào dung dịch bao gồm 0,1 mol Na
OH cùng 0,3 mol Na
Al
O2để nhận được 0,2 mol kết tủa?
Dùng phương pháp max, ta có
mol H+max= 4.nAl
O2-– 3.ntủa+ n
OH-1.Vmax = 4.0,3 – 3.0,2 + 0,1 ⇔ Vmax = 0,7 lit
3.4. Câu truyện của Kẽm
Điều như bên trên cũng xảy ra với Zn2+, Zn(OH)2và Zn
O22-; ta có những công thức khớp ứng như sau (biết chơi, không tồn tại trong chương trình).
OH + Zn2+ → tủa Zn(OH)2 với mol Zn2+ > Zn(OH)2mol OH–min= 2.ntủamol OH–max= 4.n
Zn2+– 2ntủa
Tính mol H+ + Zn
O22- → tủa Zn(OH)2 với mol Zn
O22-> Zn(OH)2mol H+min= …mol H+max= …
4. Công thức câu hỏi SẮT
4.1. Đốt fe với O2 rồi phản nghịch ứng tiếp với HNO3
Fe + O2 → hỗn hợp fe dư, Fe3O4, Fe2O3, … + HNO3 hoặc H2SO4 đặc → NO, NO2, SO2+Với HNO3⇒m
Fe= 0,7.mhỗn hợp+ 5,6.ne nhận(ne nhậntính từ mol khí NO, NO2). Từ đó ta có
Fe= 0,7.mhỗn hợp+ 5,6.n
NO2m
Fe= 0,7.mhỗn hợp+ 16,8.n
NO
+Với H2SO4đặc ⇒m
Fe= …?…(ne nhậntính từ bỏ mol khí SO2). Từ kia ta có
Fe= …?…
Ví dụ 1.Đốtmgam Fetrong oxi thu được3 gam hỗn hợp X. Hòa tan không còn X với HNO3loãng dư thu được0,56 lít khí NO( đktc, sản phẩm khử duy nhất). Tìmm?
Có mFe= 0,7.mhỗn hợp+ 16,8.n
NO= 0,7.3 + 16,8.0,025 = 2,52 gam
Ví dụ 2.Đốt cháy16,8 gam bột Fetrong khí O2, sau một thời hạn thu đượcmgam hỗn hợp rắn X. Hòa tan trọn vẹn m gam X trong hỗn hợp HNO3loãng, dư thu được0,18 mol khí NO(sản phẩm khử của độc nhất của N+5). Tìm giá chỉ trịm?
Dùng công thức mFe= 0,7.mhỗn hợp+ 16,8.n
NOThế số16,8 = 0,7.m
X+ 16,8.0,18 => m
X= 19,68
Hỗn hợp Fe, Fe3O4, Fe2O3, … + HNO3 hoặc H2SO4 đặc → muối bột Fe(NO3)3 + NO, NO2 hoặc muối Fe2(SO4)3 + SO2
+Với HNO3⇒ mmuốinitrat= 3,025.(mhỗn hợp+ 8.ne nhận); ne nhậntính trường đoản cú mol khí NO, NO2, từ kia ta có
mmuối= 3,025.(mhỗn hợp+ 8.nNO2)mmuối= 3,025.(mhỗn hợp+ 24.n
NO)mmuối= 3,025.(mhỗn hợp+8.n
NO2+24.n
NO)
+Với H2SO4đặc ⇒ mmuốisunfat= 2,5.(mhỗn hợp+ 8.ne nhận); ne nhậntính từ mol khí SO2, từ kia ta có
mmuối= 2,5.(mhỗn hợp+ 16.nSO2)Với axit HNO3
Ví dụ 3.Hòa tan hoàn toàn11,36 gam lếu láo hợp
X gồm Fe, Fe
O, Fe2O3, Fe3O4trong hỗn hợp HNO3loãng dư; thu đượcmgam muốivà1,344 lít khí NO(đktc, sản phẩm khử duy nhất). Tìmm?
Ví dụ 4.Hòa tan hoàn toàn7 gam lếu láo hợpX bao gồm Fe, Fe
O, Fe2O3, Fe3O4trong HNO3dư chiếm được 1,792 lít (đktc ) khí X gồm
NO cùng NO2vàmgam muối . Biết tỉ khối khá của X đối với H2là 19. Tínhm?
NO= n
NO2= 0,04mmuối= 3,025.(7 + 8.0,04 + 24.0,04) = 25,047 gam
Ví dụ 5.Cho22,72 gam lếu láo hợpgồm Fe, Fe
O, Fe2O3và Fe3O4phản ứng không còn với dung dịch HNO3loãng, dư thu đượcVlít khí NO(sản phẩm khử duy nhất, sinh hoạt đktc) với dung dịch X. Cô cạn dung dịch X thu được77,44 gam muối hạt khan. Search trị củaV?
NO)n
NO= 0,12 ~ 2,688 lit
Với axit H2SO4
Ví dụ 6.Hòa tan hết30 gam láo hợpX có Fe, Fe
O, Fe2O3, Fe3O4bằng H2SO4đặc nóng, dư thu được11,2 lít khí SO2(đktc, thành phầm khử duy nhất). Tínhkhối lượng muối bột khanthu được khi cô cạn dung dịch sau phản nghịch ứng?
SO2) = 2,5(30 + 16.0,5) = 95 gam
Ví dụ 7.Hòa tan hoàn toànmgam láo hợpgồm Fe
O, Fe2O3và Fe3O4cần dung dung dịch chứa0,25 mol H2SO4đặc rét (vừa đủ), thu được dung dịch chứamột muối duy nhấtvà896 ml khí SO2(đktc; thành phầm khử tốt nhất của S+6). Tìm giá chỉ trịm?
Tính muối Fe2(SO4)3từ bảo toàn mol S
0,25 mol H2SO4⇒ 0,25 mol S –> Fe2(SO4)3+ 0,04 mol SO2Tính ra 0,07 mol Fe2(SO4)3tức 28 gam muốiDùng mmuối= 2,5.(mhỗn hợp+ 16.n
SO2)
4.2. Oxit sắt và H2SO4 đặc
FexOy + H2SO4 đặc → Fe2(SO4)3 + SO2 + H2O
S trong H2SO4 đặc dùng cho 2 thừa trình
để tạo thành muối sunfat (lớp 10 hotline là sinh sản môi trường!)để tạo thành phầm khử như SO2(hổng lúc nào gặp H2S, S!)H+ trong H2SO4 đặc sử dụng cho 2 bội phản ứng
oxi hóa khử: 4H++ SO42-+ 2e → SO2+ 2H2OvớiOcủa oxit: 2H++O→ H2OGhi như sau là sai, nhưng dễ hiểu với H2SO4(*)
2H2++ 1SO42-+ 2e → 1SO2+ 2H2O1H2++ 1O → H2OBạn tất cả thấy cách làm này suy ra từ nhì phương trình sai không?n
H2SO4 ban đầu= 2.n
SO2+ 1.n
O
Ví dụ 8.
Xem thêm: Gợi Ý Những Món Quà Tặng 8/3 Cho Khách Hàng, Nhân Viên Thiết Thực
Ví dụ7ở trên có thể giải theo phong cách sau:
moxit = sắt + O
Tính fe từ bảo toàn mol S, ta có
Đã tính ra 0,07 mol Fe2(SO4)3⇒0,14 mol FeTính O từ bí quyết trênnH2SO4 ban đầu= 2n
SO2+ 1n
Othế vào 0,25 = 2.0,04 + n
O⇒0,17 mol O
Vậy m = sắt + O = 0,14.56 + 0,17.16 = 10,56 gam
Tác giả: Đỗ Trọng Toan, cya.edu.vn
Liên kết nhanh
Mời bạn trải nghiệm thêm các bài viết khác của
Bạn hãy viết bài chia sẻ trong phần bình luận dưới nếu có vướng mắc hoặc ý tưởng mới các bạn nhé! vướng mắc và ý tưởng của chúng ta luôn tuyệt vời.