Dưới đây là tóm tắt kiến thức trọng tâm Lý thuyết về Nguyên tử từ đó giúp các bạn học sinh ôn tập để nắm vững kiến thức môn Hoá học lớp 10 và hoàn thành tốt bài thi học kỳ I.
Bạn đang xem: Tóm tắt kiến thức hóa học lớp 10
I. Nguyên tử
1. Cấu tạo nguyên tử– Gồm vỏ và hạt nhân
+Vỏ nguyên tử: gồm các hạt electron (-)
+ Hạt nhân: gồm các hạt notron và proton (+)
– Nguyên tử trung hòa về điện: Số p = số e.
2. Lớp và phân lớp electron
a. Lớp electron
Lớp electron gồm các electron có mức năng lượng gần bằng nhau. Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao (từ gần nhân ra ngoài):
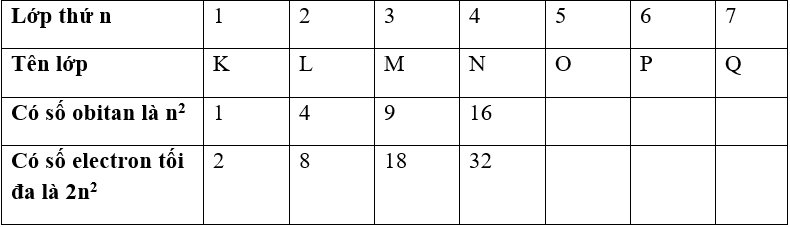
– Mỗi lớp electron chia thành các phân lớp s, p, d, f gồm các electron có mức năng lượng bằng nhau:
| Phân lớp | s | p | d | f |
| Có số obitan | 1 | 3 | 5 | 7 |
| Có số electron tối đa | 2 | 6 | 10 | 14 |
– Trong 1 lớp electron thì số phân lớp = số thứ tự lớp:
| Lớp thứ | 1 | 2 | 3 | 4 |
| Có phân lớp | 1s | 2s2p | 3s3p3d | 4s4p4d4f |
– Phân lớp electron chứa electron tối đa gọi là phân lớp electron bão hòa.
3. Các quy tắc và nguyên lí phân bố electron
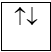
– Nguyên lí Pau-li
Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
1 obitan có 2e: 2e ghép đôi
1 obitan có 1e: 1e độc thân
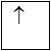
Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.– Quy tắc Hun
Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau.
4. Đặc điểm của lớp electron ngoài cùng
– Các electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố.
– Số electron lớp ngoài cùng tối đa là 8e.
+ Các nguyên tử kim loại có: 1e, 2e, 3e lớp ngoài cùng.
+ Các nguyên tử phi kim có: 5e, 6e, 7e lớp ngoài cùng.
+ Các nguyên tử khí hiếm có: 8e (He có 2e) lớp ngoài cùng.
+ Các nguyên tử có 4e lớp ngoài cùng có thể là kim loại (Ge, Sn, Pb) có thể là phi kim (C, Si).
II. Nguyên tố hóa học
– Điện tích hạt nhân Z = số p = số e.
– Số khối A = Z + N.
– Nguyên tử khối trung bình:
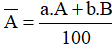
===============================================================
Quý phụ huynh có thể tham quan, đăng ký và chọn lựa cơ sở thích hợp cho con em, cũng như thuận tiện trong việc đưa rước hàng ngày.
– Cơ sở 1: 26 Phan Chu Trinh, P. Hiệp Phú, TP. Thủ Đức, TP. HCM
– Cơ sở 2: 674/7 Xa lộ Hà Nội, P. Hiệp Phú, TP. Thủ Đức, TP. HCM
– Cơ sở 3: 190 Võ Văn Ngân, P. Bình Thọ, TP. Thủ Đức, TP. HCM
– Cơ sở 4: 636 Nguyễn Thị Minh Khai, P. Tân Đông Hiệp, TP. Dĩ An, Bình Dương
Trường THCS – THPT Hoa Sen có Cơ sở 4 tại TP. Dĩ An gồm có Hệ Tiểu Học – THCS – THPT với các chế độ học Bán trú – Hai buổi.
I. Tổng hợp lý thuyết hóa học 10 đầy đủ nhất học kì 11 – Chương 1: Nguyên tử2 – Chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn3 – Chương 3: Liên kết hóa học4 – Chương 4: Phản ứng oxi hóa, khửII. Tổng hợp lý thuyết hóa 10 học kì 21 – Chương 5: Nhóm Halogen2 – Chương 6: Oxi – Lưu huỳnh3 – Chương 7: Tốc độ phản ứng – Cân bằng hóa học
Nhằm hỗ trợ các bạn học sinh trong quá trình học tập của mình, đặc biệt là môn hóa. Bài viết dưới đây sẽ tổng hợp lý thuyết hóa học 10 đầy đủ nhất cho các bạn để việc thực hiện các bài tập dễ dàng hơn.
I. Tổng hợp lý thuyết hóa học 10 đầy đủ nhất học kì 1
Để tổng hợp lý thuyết hóa học 10 đầy đủ nhất thì chúng ta chia bài viết thành 2 phần cho học kỳ 1 và 2. Trước tiên là phần lý thuyết hóa học 10 học kỳ 1.
1 – Chương 1: Nguyên tử
1a – Cấu tạo của nguyên tửNguyên tử được cấu tạo gồm phần vỏ có các electron mang điện tích âm và phần hạt nhân mang các nơtron và proton mang điện tích dương. Một nguyên tử sẽ trung hòa về điện khi số proton bằng số electron.
1b – Lớp và phân lớp electronLớp electron bao gồm các electron có mức năng lượng gần bằng nhau và được sắp xếp từ thấp đến cao và từ nhân ra vỏ.Phân lớp electron: Mỗi electron sẽ được phân thành các lớp theo thứ tự s,p,d,f. Trong 1 lớp electron thì số phân lớp sẽ bằng số thứ tự của lớp đó nếu chứa electron tối đa thì đó là phân lớp electron bão hòa.1c – Các nguyên tắc phân bổ electronNguyên lý Pau-li: Trên 1 obitan sẽ có tối đa 2e và 2e này sẽ tự chuyển động quay khác chiều nhau.Nguyên lý bền vững: Ở trạng thái cơ bản, lần lượt các obitan sẽ có mức năng lượng từ thấp đến cao.Nguyên tắc Hun: Trong 1 phân lớp, các electron sẽ phân bố số electron độc thân là tối đa và có chiều tự quay giống nhau. Thứ tự là: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p.2 – Chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn
2a – Các yếu tố trong bảng tuần hoàn các nguyên tố hóa họcBảng tuần hoàn các nguyên tố hóa học bao gồm: ô nguyên tố, chu kỳ và các nhóm nguyên tố.
2b – Nguyên tắc sắp xếp các yếu tốXếp theo chiều tăng dần của điện tích hạt nhân của các nguyên tử.Cùng số lớp electron trong nguyên tử thì được xếp thành một hàng gọi là chu kì.Cùng số e hóa trị trong nguyên tử được xếp thành một cột gọi là nhóm.2c – Định luật tuần hoànĐịnh luật này giải thích là tính chất của các nguyên tố sẽ biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử. Nếu trong cùng một chu kỳ thì tính kim loại giảm và tính phi kim tăng dần. Và trong cùng một nhóm A thì tính kim loại tăng và tính phi kim giảm dần.
3 – Chương 3: Liên kết hóa học
3a – Liên kết ion, anion và cationLiên kết ion: Khi các ion trái dấu hút nhau bằng lực hút tĩnh điện sẽ tạo thành hợp chất chứa liên kết ion. Sự liên kết phải được hình thành từ các nguyên tố có tính chất khác nhau.Anion: Nếu các nguyên tử nhận thêm e trong quá trình tham gia phản ứng hóa học thì chúng sẽ trở thành các phần tử mang điện tích âm còn gọi là anion.Cation: Nếu các nguyên tử nhường bớt e trong quá trình tham gia phản ứng hóa học thì chúng sẽ trở thành các phần tử mang điện tích dương còn gọi là cation.3b – Liên kết cộng hóa trịLà liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron được dùng chung. Bên cạnh đó, các nguyên tử phải giống nhau hoặc gần giống nhau và liên kết bằng cách góp chung các e hóa trị thì mới có liên kết này. Liên kết này được chia làm 2 loại là có cực và không cực.
3c – Liên kết kim loạiLà liên kết được hình thành giữa các nguyên tử và ion kim loại trong một mạng tinh thể nhờ có sự tham gia của các electron tự do. Liên kết này tồn tại dưới 3 dạng phổ biến: Lập phương tâm khối, lập phương tâm diện và lục phương.

Các phản ứng hóa học thường gặp.
Kết luận
Bằng việc tổng hợp lý thuyết hóa học 10 đầy đủ nhất cả học kỳ 1 và 2 đã giúp việc hệ thống kiến thức trở nên hiệu quả hơn. Từ đó, giúp học sinh hiểu và nắm bắt được định nghĩa, tính chất và các phương trình hóa học tốt hơn.
Xem thêm: Cấu hình gta 5, cấu hình gta v trên máy tính, cấu hình chơi gta 5 ổn định, mượt, max setting
Trên đây là các thông tin tổng hợp lý thuyết hóa học 10 đầy đủ nhất cho các bạn. Hy vọng với những thông tin trên có thể giúp các bạn có cái nhìn tổng quan và toàn diện nhất về các lý thuyết hóa học lớp 10. Để quá trình học tập và việc thực hiện bài tập trở nên dễ dàng hơn.